サポート
in vivoイメージングにおける生物発光と蛍光 ~ 基礎編
このページを見てくれているあなたはin vivoイメージングに関心があり、「発光 / 蛍光 / マウス」といったキーワードでインターネットを見ていたのではないでしょうか。その目的は様々と思いますが、このページでは「in vivoイメージングにおける生物発光と蛍光」の基礎について紹介していきます。
生体内における細胞や化合物の局在、量といった情報は様々な研究において非常に有用なデータとなりますが、ご存じの通り我々の体をはじめ動物の体の中を目で透かして見ることはできません。そのため、組織の透明化やラジオアイソトープ(RI)の活用など様々な生体内の可視化手法が研究・開発されています。生物発光と蛍光を用いたin vivoイメージングはこれら可視化手法の1つであり、ライブイメージングが可能であること、撮影装置の扱いが比較的容易であることなどから多くの研究者に活用されています。
<生物発光と蛍光による可視化の仕組み>
〇 生物発光
生物発光は化学反応により発光する現象であり、in vivoイメージングでは主にルシフェラーゼ(酵素)とルシフェリン(基質)の反応が用いられています(図1左)。ルシフェラーゼとルシフェリンを先天的に保持しているのはホタルなどごく一部の生物に限られているため、イメージングの事前準備として「化学反応を触媒するルシフェラーゼを発現する細胞を観察個体に移植する」または「ルシフェラーゼを発現する個体を作製する」必要があります。そして、観察直前にルシフェリンを投与することで発光が生じイメージングが可能となります(図1右)。
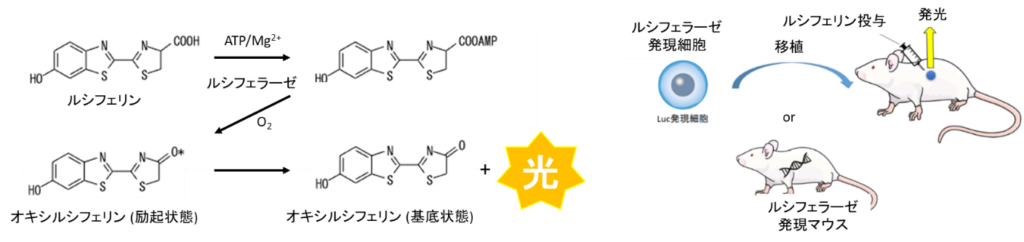
さらにO2と反応し励起状態のオキシルシフェリンとなる。オキシルシフェリンはエネルギーを光として放出することで基底状態に遷移する.
(右) in vivoイメージングにおける発光観察の準備イメージ図.
〇蛍光
蛍光はタンパク質や化合物が吸収した光エネルギーの一部を光として放出する現象です(図2左)。in vivoイメージングでは、プレート上で細胞を観察する際によく用いられているGFPよりも長波長の蛍光を発するRFPやICGといった蛍光タンパク質・色素が多く用いられているのが特徴です。生物発光と同様に「蛍光タンパク質発現細胞の移植」、「蛍光タンパク質発現マウスの作製」、「細胞や薬剤などを蛍光色素で標識する」といった事前準備は必要ですが、撮影直前の基質投与は不要です(図2右)。
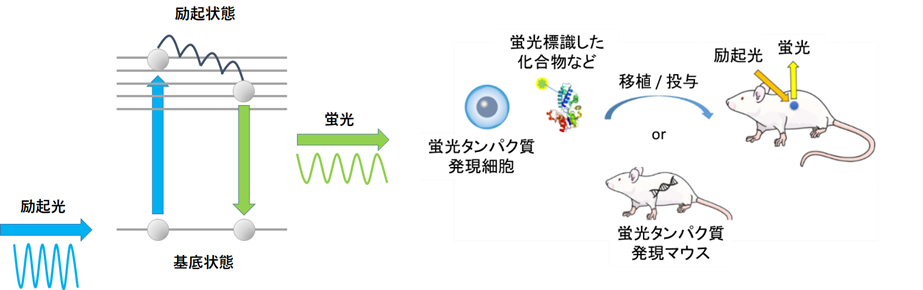
基底状態に遷移するときに蛍光を放出する. そのため、蛍光として放出される光は励起光よりもエネルギーの小さい長波長の光となる.
(右) in vivoイメージングにおける蛍光観察の準備イメージ図.
〇光の検出
発光または蛍光に起因した光をカメラで検出することで観察個体表面および内部にある観察対象を2Dまたは3Dで可視化します。2Dイメージングでは光の強さに加え、XY平面での局在と光が観察される面積を評価することが可能です。一方、3Dイメージングでは光が発せられている深さ情報も取得できるため、光の強さに加え、XYZ空間での局在および光が観察される面積と体積を評価することが可能となります。
<生物発光と蛍光の特徴>
ここからは生物発光と蛍光の違いについて、in vivoイメージングの観点から具体的に紹介していきます。
| 生物発光 | 蛍光 |
| ・光が強くバックグラウンドが低い ・発光基質であるルシフェリンが高価 ・発光強度が経時的に変化する | ・経時的な蛍光強度の変化が小さい ・色素の選択肢が豊富 ・光が弱く、自家蛍光が生じる ・撮影前に飼料の変更が必要となることがある |
〇生物発光
生物発光の最大の特徴は「発せられる光が強い」ことです。これは、より少ない観察対象の可視化を期待できることを意味します。さらに、撮影時に光るのはルシフェラーゼ発現細胞といった細工を施した観察対象のみとなるため、撮影条件に関わらず観察対象由来の光のみを常に捉えることができます。ルシフェリンが高価であることは悩ましいのですが、高シグナル・低バックグラウンドなデータ、つまりS/N比が良好なデータの取得が期待できます。
また、 データ取得の観点では発光強度が経時的に変化することを理解しておくことが重要です。生物発光は酵素反応に基づいているため、酵素近傍の基質濃度の変化に伴って発光強度が経時的に変化します(図3)。そのため、基質の投与方法や基質投与から撮影までの時間を統一するなどするといいでしょう。
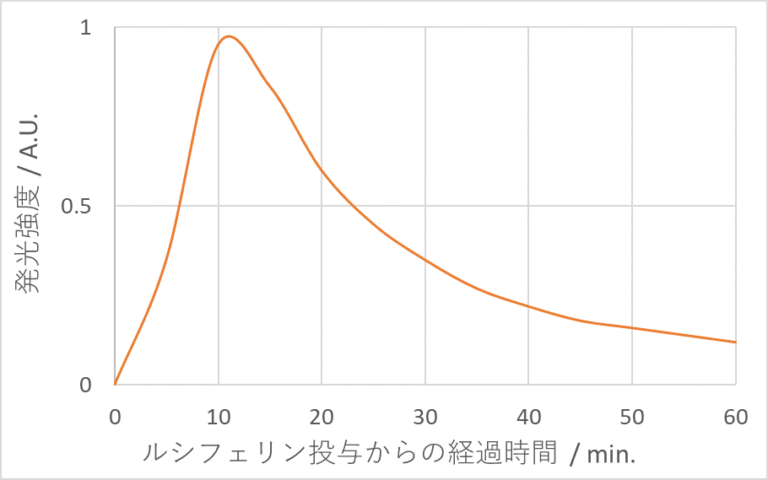
〇蛍光
蛍光の特徴の一つは「蛍光強度の経時変化が少ない」ことです。蛍光強度は励起光の強度に依存するためです。また、蛍光色素の選択肢が豊富であり、化学修飾により観察対象を直接標識できるなど、アプリケーションの幅が広いのも特徴です。
データ取得の観点では、光の強さが生物発光より弱いため観察個体による光の散乱と吸収の影響を受けやすい傾向にあります。さらに、励起光により観察個体自体が意図せず蛍光を発してしまう(自家蛍光)こともあります。RFPやICGといった長波長の蛍光を発する色素を用いることで光の散乱や吸収、自家蛍光の影響を抑制することができますが、それでも生物発光と比べると検出感度は低下する傾向にあります。また、観察個体に蛍光性のある飼料を与えていると、観察時に腸管などにて飼料由来の傾向が観察されてしまうことにも注意が必要です。
<生物発光と蛍光の選び方>
最後に生物発光と蛍光の使用例を紹介します。みなさんはどちらを選択しますか。
〇生物発光
― 腫瘍のサイズや転移の評価 / ケース1, ケース2
がん腫瘍やがん転移の観察初期では、少数の細胞から発せられる微弱な光の検出が求められます。そのためこのような場面では強い光を発し、かつ、
自家蛍光が生じない生物発光が選択されることが多いようです。
― 感染症における細菌やウイルスの動態評価 / ケース3
ルシフェラーゼ遺伝子を発現するようにした細菌やウイルスを人為的に感染させ経時的に観察することで、細菌やウイルスの生体内における挙動を評価できます。
〇蛍光
― DDS、薬物動態の評価 / ケース4, ケース5
薬剤などの低分子化合物やそれらを輸送するためのDDSシステムに用いられる高分子の場合、その多くで蛍光色素を直接修飾することが可能です。そのため、DDSや薬物動態の評価では蛍光が選択されることが多いようです。
― 部位特異的な可視化 / ケース6, ケース7
可視化対象を特異的に認識するプローブに蛍光色素を結合させることで、目的の部位や組織を可視化することも可能です。腫瘍特異な抗原を用いた腫瘍部位の可視化、炎症部位や骨形成部位に特異的なプローブを用いた部位や組織の可視化などで活用されています。
〇検出において
生物発光でも蛍光でも基本的には「イメージャー」で検出します。様々なメーカーがイメージャーを開発・販売していますが、イメージャーにおいて重要なのは「良好なS/N比のデータを取得する機構」と「実際の運用への適応度」ではないでしょうか。
前者の比較指標としてはF値で表されるレンズ性能(F値が小さいほど高感度)やノイズと表されるバックグラウンドを軽減するためのカメラの冷却能力(冷却温度が低いほど低ノイズ)などがあります。S/N比がシグナル強度とノイズ強度の比であることからわかるようにF値か冷却能力のどちらか一方が優れていればいいというわけではなく、「目的の光をより効率的に捉えられるか」がポイントです。S/N比を意識するとカメラ性能に目がいきがちですが、実はカメラと観察対象の距離といった実験上の条件一つでもS/N比は大きく変化します (光は距離に応じて減衰します。距離が2倍になると光の強さは1/4となります)。
後者については観察する個体の大きさ、数といったイメージング対象やイメージャー専任者の有無といった運用環境に基づいて検討するといいかもしれません。
最後まで読んでいただきありがとうございました。このページの内容が皆様の参考になれば幸いです。







